
-
中文 | EN

中文 | EN
发布时间:2022-11-08 00:00:00.0
LUBAC是目前唯一已知的可以催化形成线性泛素链的泛素连接酶复合物,由HOIP、HOIL-1和SHARPIN组成。LUBAC重要组分的基因缺失会引起严重的免疫功能障碍或者胚胎致死。现有的研究发现,LUBAC催化生成的线性泛素链在调控TNF介导的细胞死亡和炎症信号通路中发挥了重要作用。然而,TNF或者TNFR1的缺失并不能挽救LUBAC缺失引起的胚胎致死表型,这说明LUBAC还调控了其他的重要底物以促进存活。细胞铁死亡(ferroptosis)是一种依赖于细胞脂氧化的细胞死亡形式,其关键调控因子GPx4是一种重要的硒代半胱氨酸蛋白,参与了细胞内氧化还原稳态的调控,它的缺失同样会导致胚胎致死。那么,细胞铁死亡信号通路中是否存在LUBAC的关键底物呢?LUBAC又是否同样参与对细胞铁死亡的调控呢?
2022年10月24日,中国科学院上海有机化学研究所生物与化学交叉研究中心袁钧瑛课题组在Proc Natl Acad Sci USA. 上发表论文“HOIP modulates the stability of GPx4 by linear ubiquitination”对这一系列问题进行了探索。

作者发现LUBAC重要组分HOIP的缺失可以促进RSL3和Erastin诱导的细胞铁死亡和脂质过氧化物的累积,该促进作用具有时间和浓度依赖性,且该促进作用可以被回补野生型HOIP挽救但不能被酶活突变(C879S)的HOIP挽救,说明LUBAC调控细胞脂氧化和铁死亡依赖于其泛素连接酶活性。同时,作者研究发现,HOIP缺失不影响GPx4缺失引起的细胞铁死亡,说明GPx4可能是LUBAC调控细胞铁死亡的重要底物。作者通过一系列体内体外的实验证明了这一猜想,即LUBAC可以催化GPx4形成线性泛素链。
此外,作者发现,在细胞铁死亡发生的过程中,GPx4招募LUBAC催化了自身线性泛素链的形成,从而抵抗细胞铁死亡的发生。这一招募过程依赖于GPx4本身已有的泛素链,如K48泛素链、K63泛素链等。更为有趣的是,当GPx4的活性位点硒代半胱氨酸位点发生突变时,GPx4本身的泛素化水平降低,同时招募LUABC的能力受损,这提示GPx4的活性位点对于调控其泛素化水平发挥了重要作用。
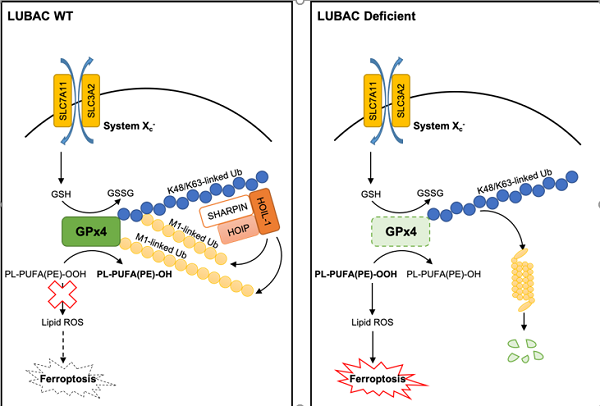
这项研究不仅解析了线性泛素化调控铁死亡的作用靶点及分子机制,丰富了线性泛素化和铁死亡的信号通路,并提示铁死亡在发育和免疫中也扮演了重要角色。
中国科学院上海有机化学研究所生物与化学交叉研究中心袁钧瑛教授和李盈副研究员是该文章的通讯作者,中国科学院上海有机化学研究所生物与化学交叉研究中心董康耘博士为该文第一作者。该项研究受国家自然科学基金委、上海市科委、国家重点研发计划和中国科学院资助完成。
