
-
中文 | EN

中文 | EN
发布时间:2025-09-18 00:00:00.0
程序性坏死(Necroptosis) 作为一种独立于凋亡的程序性细胞死亡方式,在神经退行性疾病、炎症性疾病及肿瘤发生发展中均发挥着重要作用[1-4]。执行坏死功能的核心蛋白质机器是由受体相互作用蛋白激酶1(RIPK1) 与 RIPK3 共同组装形成的坏死小体(necrosome)。近年研究表明,坏死小体中的RIPK1 与RIPK3能够通过RIP同型相互作用基序(RHIM)形成具淀粉样特征的功能性纤维,在细胞内起始并放大坏死信号传导[5-7];与之相对,Tau与α-synuclein等病理性淀粉样聚集体在多种神经退行性疾病中作为关键致病因子,并已被证实具“朊蛋白样(prion-like)”的自催化与跨细胞传播能力[8]。由此引出一个关键问题:在坏死过程中形成的RIPK1/RIPK3功能性纤维是否也会在细胞膜破裂后逸出并被邻近细胞摄取,从而以“结构模板”方式在细胞间传递并放大细胞死亡信号?
2025年9月,中国科学院上海有机化学研究所生物与化学交叉研究中心袁钧瑛与刘聪团队合作,在Proceedings of the National Academy of Sciences of the United States of America 上发表题为 “Intercellular propagation of RIPK1/RIPK3 amyloid fibrils” 的研究论文。该研究首次发现,在细胞程序性坏死中形成的RIPK1/RIPK3功能性淀粉样纤维,不仅在细胞内组装驱动坏死信号,还会在坏死细胞膜破裂后释放到胞外,被受体细胞摄取并作为“种子”诱导后者内源性坏死小体的形成,启动细胞死亡过程。这一发现表明这些功能性坏死小体纤维具备类似朊蛋白(prion)的跨细胞传播能力,揭示了一种全新的细胞死亡信号传递机制。

研究人员首先在细胞尺度重建了坏死小体纤维的“组装—释放—再播种”全过程:利用STED超分辨成像,追踪表达RIPK3的HeLa细胞稳转株在坏死刺激下,RIPK1与RIPK3由点状转为小杆状和进一步的纤维状聚集体。长时程活细胞成像直接记录到细胞发生程序性坏死的膜爆裂瞬间,已形成的坏死小体被迅速喷射入培养基;对浓缩的上清进行负染电镜观察,可见典型淀粉样纤维,而对照无此结构;免疫金标记进一步证实这些细胞外纤维含活化RIPK1、RIPK3及下游MLKL。将从坏死细胞免疫富集的RIPK1/RIPK3纤维直接加入受体细胞后,外源纤维无需转染即可被主动摄取,并在受体细胞内作为“模板”招募内源RIPK1/RIPK3再组装为纤维,诱导受体细胞发生显著的程序性坏死;在未抑制凋亡的条件下还观察到PARP剪切,提示该纤维信号亦可并发触发凋亡途径。由此勾勒出坏死小体纤维跨细胞传播与致死信号放大的完整路径。
为验证“纤维态”本身的因果作用,研究者体外重组仅含RHIM结构域的RIPK1、RIPK3片段,制备三类预制纤维(RHIM-PFFs),经超声剪切成均一纤维种子并以脂质体导入细胞。结果显示三类RHIM-PFFs均能强效诱导细胞死亡,而相同蛋白的单体或无关病理纤维(如α-synuclein PFFs)几乎无效;受体细胞内可见自身表达的RIPK1/RIPK3被促成纤维状共组装,并伴随RIPK1 S166位点与RIPK3 S227位点磷酸化的增强。以上证据共同表明:特定的RIPK1/RIPK3功能性淀粉样纤维结构本身是跨细胞传递坏死信号的核心载体与效应形式(图1)。
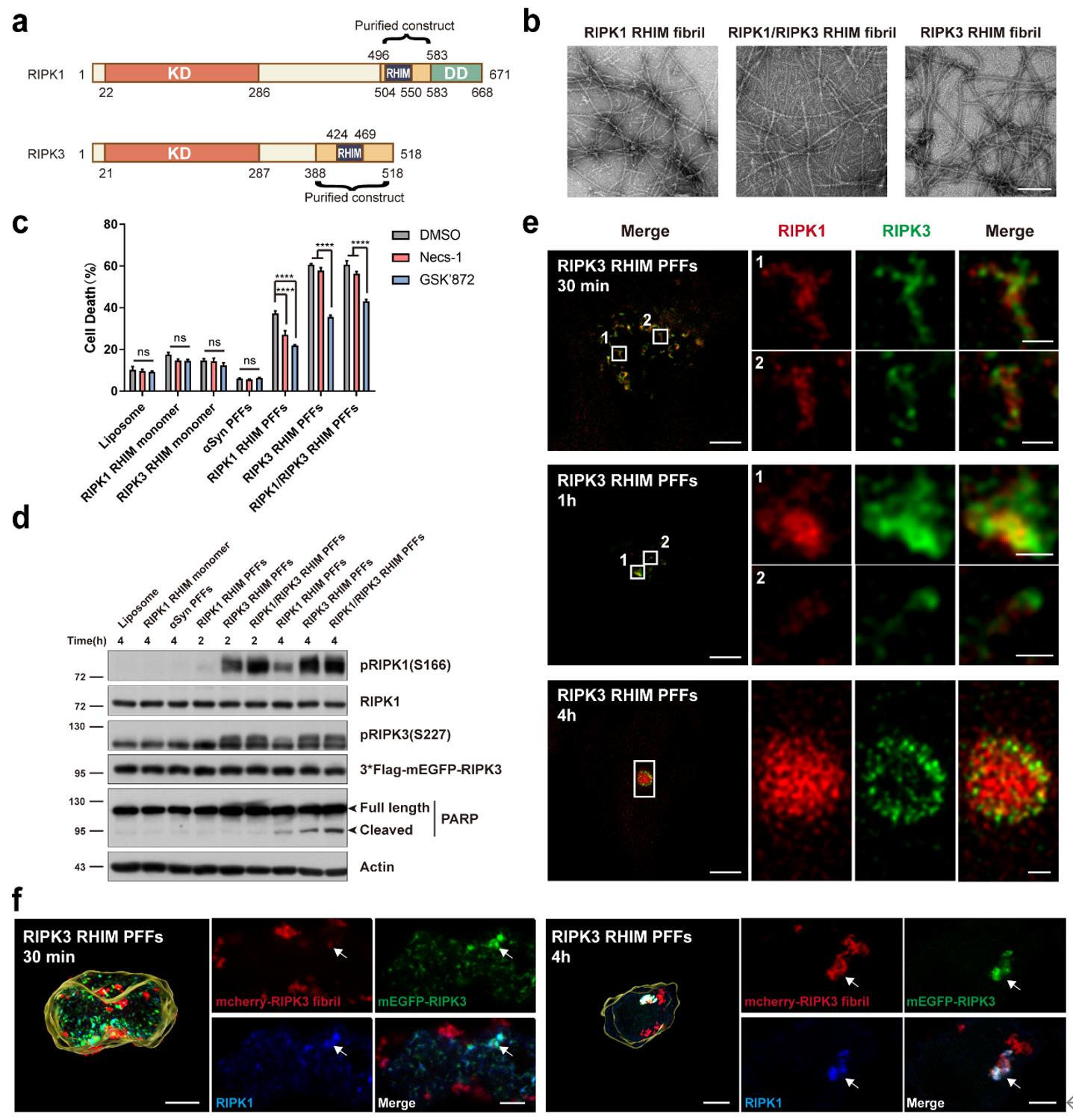
图1:RHIM PFFs诱导受体细胞发生程序性死亡
为了进一步阐释这些坏死小体纤维呈现“播种”扩散能力的结构基础,研究人员对RIPK1/RIPK3纤维进行了冷冻电镜三维结构解析。RIPK1和RIPK3的RHIM核心片段纤维都呈现出高度相似的“S形”折叠构象,其使得RIPK1纤维能够作为模板“交叉播种”诱导RIPK3的加入聚集。换言之,RIPK1/RIPK3纤维可形成交错排列的β折叠结构,使两种蛋白的RHIM界面精确对接,从而实现信号在纤维上的扩增和不同蛋白间的传递。这一发现揭示了坏死小体纤维在信号放大以及跨细胞传播过程中的结构基础。
为了验证该S形结构对信号传播功能的必要性,研究人员进行了关键残基的定点突变实验。针对RIPK3-RHIM纤维的“S形”核心区域引入破坏其结构的突变,成功阻断了RIPK1/RIPK3纤维的形成,并且严重削弱了细胞内坏死信号的传导。这一结果充分证明了S形淀粉样折叠构象对于坏死途径信号传播的关键作用:没有这种特殊的纤维构象,就无法实现RIPK1/RIPK3的聚集和后续的细胞死亡信号放大。
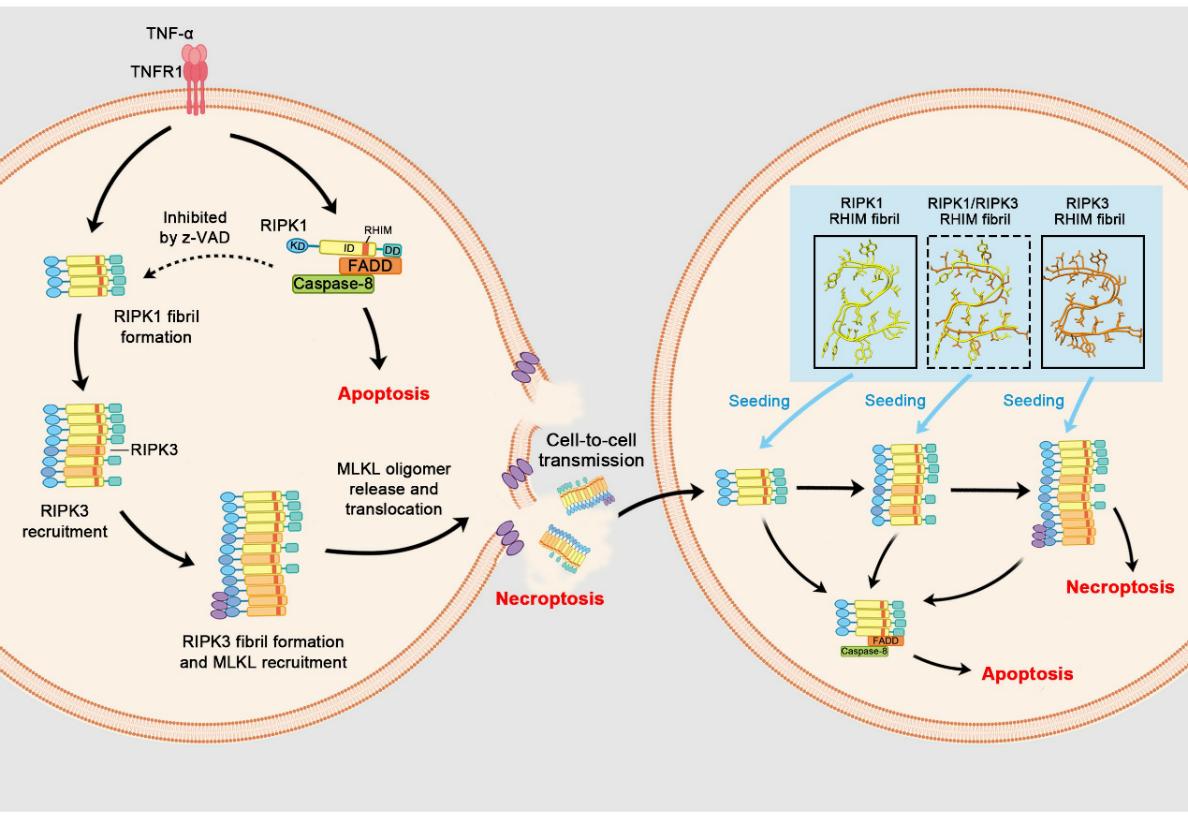
图2:RIPK1/RIPK3淀粉样纤维跨细胞传播坏死信号的工作模型
本项研究首次揭示了功能性坏死小体淀粉样纤维可以在细胞之间传播坏死信号,为细胞死亡信号的跨细胞放大提供了全新机制(图2)。长期以来,淀粉样纤维在细胞间的传播更多见于神经退行性疾病的病理聚集体的研究,人们早已认识到这些病理性蛋白纤维具有自我传播、跨细胞传递并导致细胞毒性的特性。相比之下,对于生理功能性淀粉样纤维的研究才刚刚兴起。本研究表明,RIPK1/RIPK3坏死小体纤维作为一种“功能性”淀粉样纤维,同样具备类似朊蛋白的传播特性。这一发现提示,某些疾病相关的病理性蛋白质淀粉样聚集体的起源,很可能来自于正常生理过程中功能性纤维的不当扩散。换言之,原本用于细胞信号转导的功能性纤维,一旦逃离细胞或调控失控,可能在邻近细胞中“播种”出病理聚集体,从而在组织中造成级联放大效应。
总而言之,该研究为我们理解坏死相关的炎症反应、神经元损伤以及神经退行性疾病中的信号放大机制提供了新的视角和思路。未来,随着这一机制在体内模型中的进一步探索,人们有望揭示在病理情况下功能性淀粉样纤维扩散导致疾病进展的证据。这不仅深化了我们对程序性坏死与疾病联系的认识,也有可能为干预坏死性炎症或神经变性过程提供新的潜在靶点和策略。
中国科学院上海有机化学研究所生物与化学交叉研究中心已毕业的马烨阳博士,博士生张秋原,为该论文的共同第一作者。中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员和袁钧瑛院士为该论文的共同通讯作者。本工作受到中国科学院、国家自然科学基金、上海市科委、上海尚思自然科学研究院等基金的资助。
原文链接:https://doi.org/10.1073/pnas.2507028122
Reference:
1. Yuan, J., P. Amin, and D. Ofengeim, Necroptosis and RIPK1-mediated neuroinflammation in CNS diseases. Nature Reviews Neuroscience, 2019. 20(1): p. 19–33.
2. Xu, D., C. Zou, and J. Yuan, Genetic Regulation of RIPK1 and Necroptosis. Annual review of genetics, 2021. 55: p. 235–263.
3. Gong, Y., et al., The role of necroptosis in cancer biology and therapy. Molecular Cancer, 2019. 18(1): p. 100.
4. Caccamo, A., et al., Necroptosis activation in Alzheimer's disease. Nature Neuroscience, 2017. 20(9): p. 1236–+.
5. Mompeán, M., et al., The Structure of the Necrosome RIPK1-RIPK3 Core, a Human Hetero-Amyloid Signaling Complex. Cell, 2018. 173(5): p. 1244–1253.e10.
6. Wu, X., et al., The structure of a minimum amyloid fibril core formed by necroptosis-mediating RHIM of human RIPK3. Proceedings of the National Academy of Sciences, 2021. 118(14): p. e2022933118.
7. Li, J.X., et al., The RIP1/RIP3 Necrosome Forms a Functional Amyloid Signaling Complex Required for Programmed Necrosis. Cell, 2012. 150(2): p. 339–350.
8. Li, D. and C. Liu, Conformational strains of pathogenic amyloid proteins in neurodegenerative diseases. Nature Reviews Neuroscience, 2022. 23(9): p. 523–534.
