JACS|刘聪与合作者揭示多巴胺修饰抑制阿尔兹海默病Tau病理聚集的机制
Tau 蛋白异常聚集形成淀粉样纤维是阿尔兹海默病(AD)、额颞叶痴呆等多种 Tau 蛋白病(tauopathies)的核心病理事件。大量研究表明,Tau 的翻译后修饰(post-translational modifications, PTMs),尤其是异常磷酸化,在调控其聚集行为和致病性中起关键作用。然而,不同 PTMs 之间是否存在相互调控关系,以及这些修饰如何在原子分子层面重塑 Tau 病理聚集体的组装结构,长期以来仍缺乏直接的结构证据。
中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员课题组与北京大学化学与分子工程学院王初教授课题组长期紧密合作,致力于内源性小分子修饰在神经退行性疾病致病蛋白相关靶标的发现、功能及结构进行多维度系统研究。合作团队的前期研究揭示了多巴胺修饰对Tau蛋白功能的保护性调控作用 (Nat. Chem. Biol, 2025)。近期,合作研究团队针对多巴胺修饰保护作用的分子机制及结构基础进一步深入研究,2026年1月,在J. Am. Chem. Soc.期刊上发表题为 “Dopamine-Induced Tau Modification Prevents Pathological Phosphorylation and Generates a Distinct Fibril Polymorph” 的研究论文。该研究系统揭示了多巴胺修饰在抑制 Tau 病理性磷酸化、阻断纤维形成以及重塑 Tau 淀粉样纤维结构中的关键作用,从原子分子层面阐明一种关键内源性代谢修饰调控 Tau 病理的新机制。

研究团队以 3R Tau 片段 K19 为模型,结合生物化学、质谱、核磁共振(NMR)与冷冻电镜(cryo-EM)等多种技术,系统研究多巴胺对 Tau 的共价修饰及其结构调控。结果表明,多巴胺在氧化条件下可特异性修饰 Tau 的 Cys322 位点。NMR 分析显示,该修饰不仅可以引起局部构象变化,还显著削弱 Tau 微管结合区内多个与疾病密切相关位点(如 Ser262、Ser324 和 Ser352)的磷酸化水平,揭示多巴胺修饰与 Tau 磷酸化之间存在直接的分子“串扰”关系(图1)。
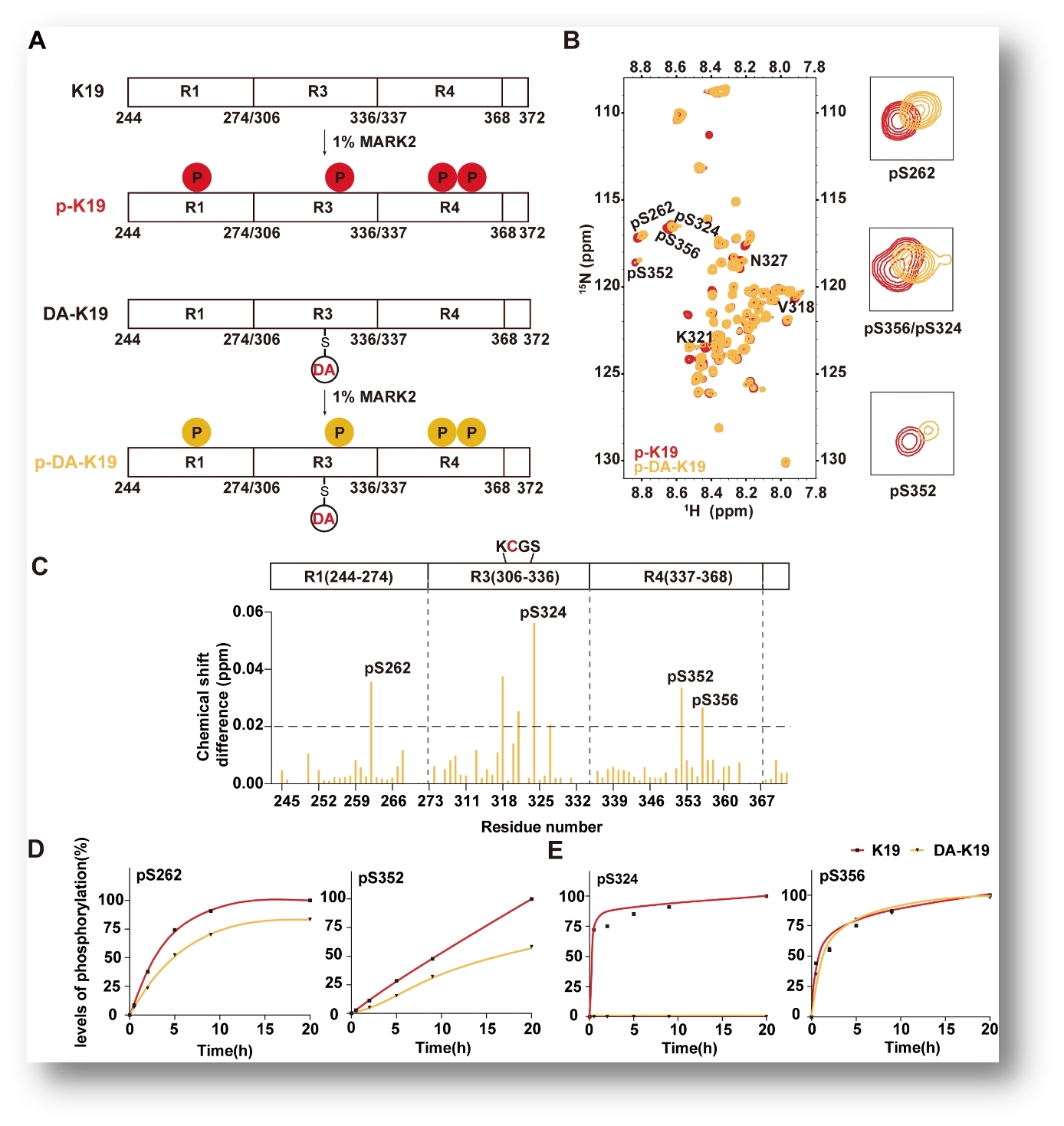
图1:多巴胺修饰降低 Tau 蛋白的磷酸化水平
在功能层面,多巴胺修饰显著抑制Tau 的淀粉样聚集。体外聚集实验和电镜成像显示,多巴胺修饰可剂量依赖性地抑制 Tau 纤维形成,并显著降低其在细胞模型中的播散(seeding)能力。进一步的稳定性分析表明,由多巴胺修饰 Tau 形成的少量纤维在冻融循环和蛋白酶消化条件下更易解聚,提示其结构稳定性明显低于未修饰 Tau 纤维。
为阐明这一现象的分子机制与结构基础,研究团队通过冷冻电镜对多巴胺修饰的 Tau 纤维进行结构解析,分辨率 达3.55 Å。纤维结构解析表明,该纤维呈现出一种前所未见的 Tau 纤维多态构象,其有序核心仅由 11 个氨基酸残基构成,是迄今报道核心最小的 Tau 淀粉样纤维结构。该核心主要依赖 VQIVYK 关键聚集基序形成极简的疏水界面,而 Cys322 及其邻近区域完全被排除在有序核心之外。这从原子层面阐释了多巴胺修饰导致Tau 纤维的稳定性下降,并阻断其向典型致病构象的成熟转变。
该研究从生化及结构生物学角度系统阐明了多巴胺这一内源性小分子代谢物如何通过共价修饰精细调控 Tau 的病理修饰与聚集命运。一方面,本研究揭示了多巴胺修饰在抑制 Tau 病理性磷酸化和聚集中的保护作用;另一方面,也展示了PTMs作为“分子开关”重塑淀粉样纤维多态性的调控机制 (图2)。该工作为基于内源性小分子代谢或修饰通路的AD干预策略提供新思路, 对基于靶向Tau的药物研发提供新的靶标及方向。
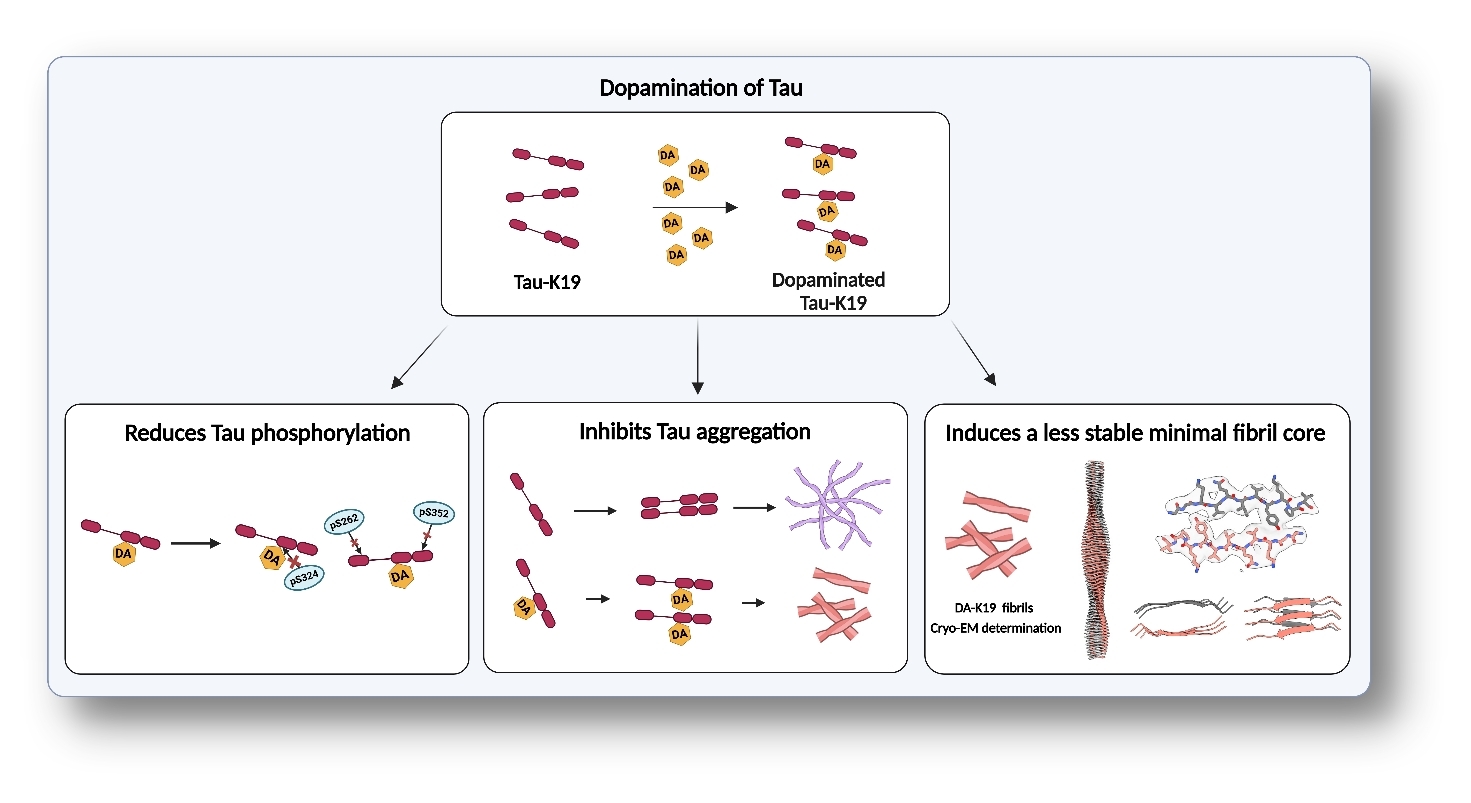
图2:多巴胺修饰调节 Tau 的聚集及其结构稳定性
本研究通讯作者为中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员、北京大学化学与分子工程学院王初教授课题组肖伟弟副研究员。中国科学院上海有机化学研究所生物与化学交叉研究中心2023届博士毕业生刘正涛、上海交通大学Bio-X研究院2021级博士研究生李想、北京大学化学与分子工程学院2023届博士毕业生王倩雯、刘聪课题组2022级博士研究生刘凯恩为论文共同第一作者。本研究工作得到了国家自然科学基金项目、上海市科委项目、上海尚思自然科学研究院项目及中国科学院项目的大力支持。
附件下载:

